(Este artículo fue traducido, adaptado e impreso con autorización exclusiva del grupo de revistas de Review de Jobson Medical Information. Su reproducción está prohibida).
Por Yavuz Cakir, MD, y Justis P. Ehlers, MD.
Puntos a tomar en cuenta:
La creciente población en riesgo de enfermedades relacionadas con la retina y la necesidad de un manejo preciso de estos pacientes pueden aumentar de manera importante mediante el uso de tecnología basada en inteligencia artificial (IA).
La imagenología avanzada ha ampliado la adquisición de datos sobre enfermedades de la retina, lo que ha generado la posibilidad de nuevos biomarcadores, que los sistemas integrados de IA tienen el potencial de detectar, cuantificar y extraer.
Biografía:
El Dr. Cakir es investigador fellow en el Tony and Leona Campane Center para la Excelencia en Cirugía Guiada por Imagen e Investigación Avanzada de Imágenes en el Cole Eye Institute, Cleveland Clinic, Cleveland.
El Dr. Ehlers ocupa la cátedra de Investigación Oftalmológica de Norman C. y Donna L. Harbert y es director del Centro Tony y Leona Campane para la Excelencia en Cirugía Guiada por Imagen e Investigación Avanzada de Imágenes en el Cole Eye Institute.
Divulgaciones:
El Dr. Cakir no tiene relaciones relevantes que revelar.
El Dr. Ehlers informó relaciones con Novartis, Zeiss, Leica, Beyeonics, Alcon, Allergan/AbbVie, Adverum, Oxurion, Roche, Allegro, Stealth, RegenxBio, Iveric bio, Boerhinger-Ingelheim, Apellis y Regeneron Pharmaceuticals.
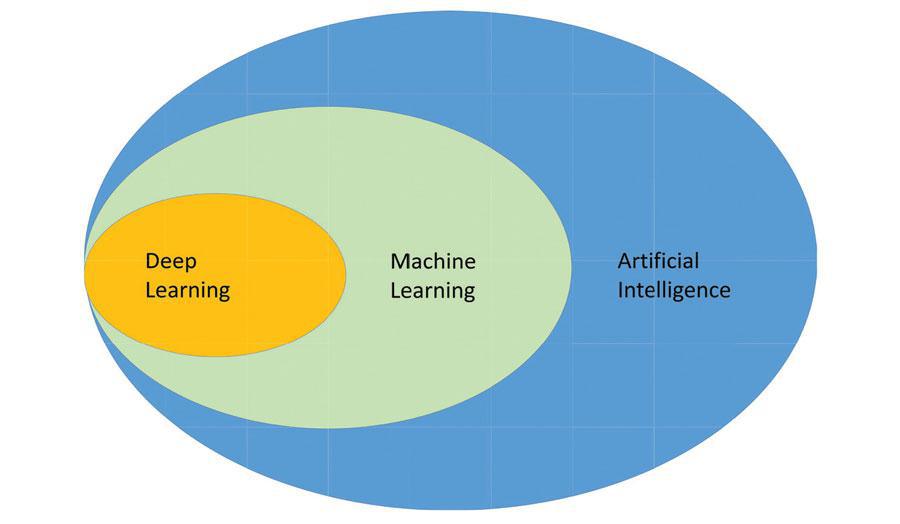
La inteligencia artificial (IA) es la capacidad de un sistema informático para aprender, adaptarse y realizar tareas complejas de modo que imita el pensamiento racional. Machine learning es un subconjunto de la IA (Figura 1). Los avances en machine learning, el proceso mediante el cual los algoritmos y las máquinas aprenden de la experiencia, han permitido mejoras dramáticas en el despliegue de la IA en la oftalmología y el estudio de las enfermedades de la retina.
Figura 1. Cómo se relacionan entre sí inteligencia artificial, machine learning y deep learning. Este último es un subconjunto del machine learning, que es un subconjunto de la IA.
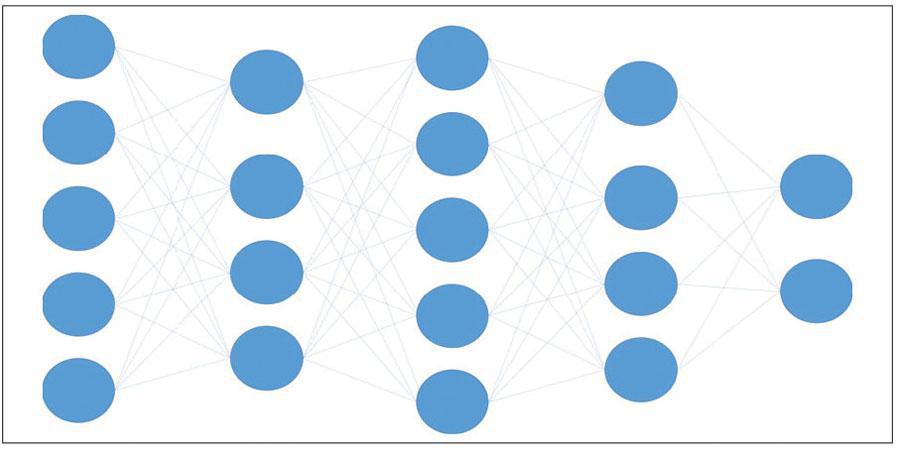
Uno de los desarrollos significativos en machine learning es la red neuronal, que es una serie de matrices numéricas de nodos conectados que interactúan de tal manera que permiten cálculos complejos con capas sintonizables ocultas que podrían ajustar las conexiones entre los nodos (Figura 2). Estas redes son, en general, computacionalmente exigentes, pero adeptas a capturar relaciones no lineales complejas. A medida que la capacidad y el potencial de las tarjetas gráficas y el poder de cómputo aumentaron enormemente, el tamaño y la profundidad de las redes neuronales aumentaron considerablemente, lo que resultó en redes más profundas que se volvieron capaces de reconocer patrones cada vez más abstractos.
Figura 2. La red neuronal convolucional (“Convolutional Neural Network” - CNN) es una arquitectura de red de deep learning que aprende directamente de los datos. Una CNN, al igual que otras redes neuronales, se compone de una capa de input, una capa de output y varias capas ocultas en el medio. Estas capas realizan operaciones en los datos con el objetivo de aprender de ellos atributos específicos.
La complejidad, la precisión y el reconocimiento de los patrones abstractos de las redes neuronales se han vuelto poderosos lo suficiente como para rivalizar con el rendimiento humano en una gama cada vez más amplia y difícil de tareas. El impresionante rendimiento de estas redes neuronales profundamente construidas ha creado, por consiguiente, todo un campo de investigación técnica dedicado a desarrollarlas y comprenderlas, incluido el deep learning (DL). Los algoritmos de DL son la forma más capaz de manejar tareas complejas y comprenden la mayoría del trabajo de IA que se realiza en la actualidad.
Aplicaciones de la IA en retina
La subespecialidad de retina es particularmente adecuada para el despliegue y la exploración de la IA debido a la facilidad de adquisición de imágenes y datos médicamente relevantes. Esto, combinado con el envejecimiento de la población mundial – cada vez más diagnosticada con enfermedades crónicas –, sugiere una gran oportunidad para la expansión de la investigación de la IA en la medicina retiniana.
Según un estudio de la Organización Mundial de la Salud, de 2014, se espera que el número de pacientes con DMAE en 2040 alcance los 288 millones, a nivel mundial.1 La diabetes mellitus tiene una prevalencia global que varía entre el 2% y el 12%.2 En estudios del mundo real, uno de cada tres pacientes con diabetes tiene retinopatía diabética (RD), y uno de cada tres pacientes con RD tiene retinopatía que amenaza la visión.3
Dado el gran número de personas afectadas por estas enfermedades y el potencial para comprenderlas y diagnosticarlas mejor utilizando la IA, vale la pena comprender las aplicaciones específicas de la IA en oftalmología.
La IA en DMAE
Si bien no existe un tratamiento aprobado por la FDA para la degeneración macular seca relacionada con la edad,4múltiples terapias en ensayos clínicos han demostrado resultados iniciales prometedores. Sin embargo, a medida que nuestros paradigmas de tratamiento se expanden para incluir la DMAE seca, surgirán múltiples nuevos desafíos en la detección y el monitoreo de esta enfermedad altamente prevalente.
Necesitaremos la estratificación del riesgo de los casos de DMAE seca para identificar con precisión los ojos en riesgo de progresión de la enfermedad, para predecir los ojos con mayor probabilidad de beneficiarse de la terapia y para maximizar potencialmente el enriquecimiento de los ensayos clínicos. Optimizar el enfoque de precisión para el manejo de la DMAE seca ayuda facilitar el tratamiento de los pacientes con mayor riesgo de progresión y propiciará identificar los ojos que podrían beneficiarse de la terapia.
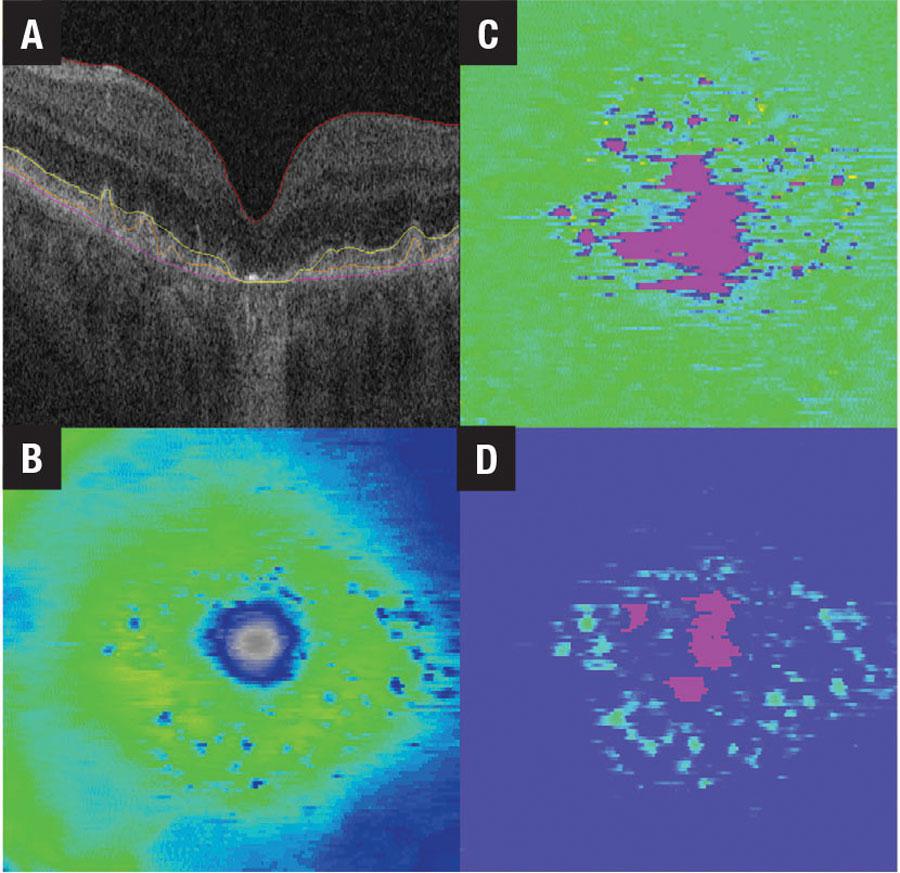
Realizar una estratificación de riesgo rápida y eficaz en una población en crecimiento y que envejece requiere diagnósticos rápidos, baratos y precisos. Los sistemas habilitados para IA son adecuados para abordar estas preocupaciones. Las técnicas de imagen, como tomografía de coherencia óptica, autofluorescencia del fondo de ojo y angiografía OCT, pueden generar rápidamente datos detallados en cantidades suficientes para entrenar los sistemas de IA para identificar biomarcadores médicamente útiles y automatizar la caracterización de la enfermedad (Figura 3, abajo). La incorporación de esta información y la detección automatizada en las plataformas de software médico estándar de atención permite un monitoreo longitudinal escalable, lo que proporciona una información valiosa sobre los resultados del tratamiento.
Figura 3. Los mapas de espesor del tejido retiniano de un paciente con degeneración macular no neovascular relacionada con la edad, incluyen A) B-scan con membrana limitante interna, epitelio pigmentario retiniano, zona elipsoide y segmentación de la línea de la membrana de Bruch; B) mapa de espesor ILM-RPE; C) mapa de espesor EZ-RPE; y D) mapa de espesor de membrana RPE-Bruch.
Se han estudiado numerosos biomarcadores de imagenología de la DMAE no neovascular, incluidos los focos hiperreflectivos intrarretinianos (HRF), las lesiones drusenoides complejas (DL, por ejemplo, la reflectividad heterogénea), los depósitos drusenoides subretinianos (SDDs) y la carga de drusas. 5,6 La predicción del desarrollo y la progresión de GA es un área clave del enfoque de la investigación. 7–10 Un estudio reciente encontró que la integridad de la zona elipsoide y la caracterización cuantitativa de los compartimentos del epitelio pigmentario subretiniano tienen un alto valor predictivo en la progresión a la GA subfoveal. 11
En la DMAE neovascular, la evaluación de las características y la caracterización precisa del líquido son importantes para maximizar el control de la enfermedad y los resultados. La OCT es el estándar de oro para monitorear e identificar características de fluidos. Históricamente, las características del fluido suelen evaluarse de manera binaria (por ejemplo, presencia/ausencia de un fluido de interés específico).
Con el advenimiento de los sistemas habilitados para IA, ahora es factible una caracterización extensa del fluido en nDMAE, incluido el análisis del volumen de fluido y la clasificación específica del tipo de fluido. La caracterización volumétrica de fluidos, la dinámica de fluidos y la volatilidad exudativa, y la cuantificación volumétrica de la fibrosis subretiniana y el material hiperreflectivo se han establecido en varios estudios. 12–14
En general, existen muchas oportunidades potenciales para el despliegue y la integración de herramientas basadas en IA para la gestión de la DMAE.
IA en RD
Los estudios anticipan que para el año 2030, 450 millones de personas tendrán diabetes en todo el mundo: 150 millones con RD leve y alrededor de 30 millones con edema macular diabético. 15,16 Si bien la RD es tratable, la detección lenta y costosa puede ser una barrera importante cuando se trata a grandes poblaciones. La IA está bien posicionada para realizar mejoras significativas en estos procesos de detección al tiempo que se integra en plataformas holísticas diseñadas para coordinarse con tratamientos para otras complicaciones típicamente resultantes de la diabetes.17
Un ejemplo de fusión de detección de la retinopatía diabética con IA es IDx-DR (Digital Diagnostics), el primer dispositivo autónomo aprobado por la FDA que emplea software de inteligencia artificial. 18 Un ensayo pivotal de 900 pacientes informó que la sensibilidad y especificidad del dispositivo para la detección de la diabetes fueron del 87.4% y el 89.5%, respectivamente.
Si el software detecta una RD grave, se remite al paciente a un profesional de la visión, y si no la identifica como grave o moderada, se le indica volver a examinarse en un año. El estudio informó que la detección de RD ha tenido un éxito por encima de umbrales específicos al remitir a las personas con síntomas de RD a centros especializados. 18 La idea es reducir la carga de pacientes en los centros terciarios, lo que permite a los proveedores dedicar más tiempo a pacientes que necesitan atención avanzada.
Si bien la terapia anti-VEGF se usa ampliamente para tratar el EMD, los especialistas en retina no están de acuerdo sobre la frecuencia o duración ideal del tratamiento, o qué pacientes responderán, lo que resulta en un tratamiento costoso y potencialmente más frecuente de lo necesario.
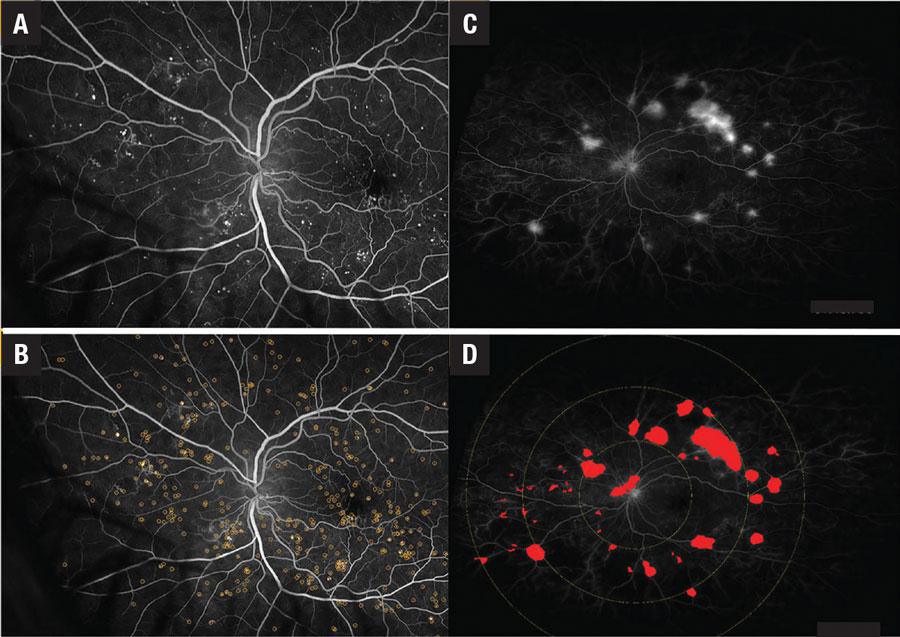
Los algoritmos de deep learning podrían ser capaces de reconocer nuevas características indetectables por el ojo humano e incorporar biomarcadores complejos existentes, tales como biomarcadores de angiografía de fluoresceína de campo ultraancho (UWFA, por su sigla en inglés) (área sin perfusión, índice isquémico, fugas y recuentos de microaneurismas).19,20 Estos algoritmos también han reconocido los siguientes biomarcadores OCT (Figura 4): 21–26
Figura 4. A,B) La angiografía con fluoresceína temprana muestra microaneurismas con y sin anotación en un paciente con retinopatía diabética. C, D) La AF de campo ultra ancho tardía muestra fugas con y sin anotaciones en un paciente con RD.
-
Espesor del subcampo central y desorganización de las capas internas de la retina (DRIL)
-
Focos hiperreflectivos;
-
Integridad de la zona elipsoide;
-
Índice de líquido retiniano;
-
Volatilidad del líquido retiniano.
Se ha demostrado que estos marcadores se correlacionan con la gravedad de la RD. Muchos de estos parámetros, como los parámetros cuantitativos de UWFA, incluido el recuento de MA panretiniano, la isquemia y el índice de fuga, se han asociado fuertemente con la gravedad de la RD. 20
Al igual que con la DMAE, la rápida proliferación de terapias nuevas y emergentes proporciona una necesidad y oportunidad únicas para optimizar la toma de decisiones de tratamiento utilizando un enfoque basado en la precisión. Los sistemas habilitados para IA que proporcionan información sobre la respuesta terapéutica y el pronóstico pueden mejorar no solo la detección y el diagnóstico, sino que también pueden ayudar a optimizar el tratamiento real para un paciente determinado.
Conclusión:
La IA está a punto de expandirse dramáticamente en los próximos años, dado que la creciente población de pacientes con necesidades oftálmicas puede superar los métodos tradicionales de detección y seguimiento de enfermedades crónicas. Los sistemas habilitados para IA pueden ayudar a mitigar algunos de estos desafíos al administrar eficientemente grandes cantidades de datos y tener la capacidad única de extraer características clave relevantes para el manejo de enfermedades, incluida la identificación de biomarcadores clave de imágenes. RS
Bibliografía
- Wong WL, Su X, Li X, et al. Global prevalence of age-related macular degeneration and disease burden projection for 2020 and 2040: A systematic review and meta-analysis. Lancet Glob Health. 2014;2:e106-116.
- Sabanayagam C, Banu R, Chee ML, et al. Incidence and progression of diabetic retinopathy: A systematic review. Lancet Diabetes Endocrinol. 2019;7:140-149.
- Lee R, Wong TY, Sabanayagam C. Epidemiology of diabetic retinopathy, diabetic macular edema and related vision loss. Eye Vis (Lond). 2015;2:17.
- Handa JT, Bowes Rickman C, Dick AD, et al. A systems biology approach towards understanding and treating non-neovascular age-related macular degeneration. Nat Commun. 2019;10:3347.
- Toth CA, Tai V, Chiu SJ, et al. Linking OCT, angiographic, and photographic lesion components in neovascular age-related macular degeneration. Ophthalmol Retina. 2018;2:481-493.
- Nassisi M, Lei J, Abdelfattah NS, et al. OCT risk factors for development of late age-related macular degeneration in the fellow eyes of patients enrolled in the HARBOR study. Ophthalmology. 2019;126:1667-1674.
- Bogunovic H, Montuoro A, Baratsits M, et al. Machine learning of the progression of intermediate age-related macular degeneration based on OCT imaging. Invest Ophthalmol Vis Sci. 2017;58:BIO141-BIO150.
- Hirabayashi K, Yu HJ, Wakatsuki Y, Marion KM, Wykoff CC, Sadda SR. Optical coherence tomography risk factors for development of atrophy in eyes with intermediate age-related macular degeneration. Ophthalmol Retina. 2022;S2468-6530 (22) 00486-9.
- Riedl S, Vogl WD, Mai J, et al. The effect of pegcetacoplan treatment on photoreceptor maintenance in geographic atrophy monitored by artificial intelligence-based OCT analysis. Ophthalmol Retina. 2022;S2468-6530 (22)00285-8.
- Niu S, de Sisternes L, Chen Q, Rubin DL, Leng T. Fully automated prediction of geographic atrophy growth using quantitative spectral-domain optical coherence tomography biomarkers. Ophthalmology. 2016;123:1737-1750.
- Sarici K, Abraham JR, Sevgi DD, et al. Risk classification for progression to subfoveal geographic atrophy in dry age-related macular degeneration using machine learning-enabled outer retinal feature extraction. Ophthalmic Surg Lasers Imaging Retina .2022;53:31-39.
- Ehlers JP, Patel N, Kaiser PK, et al. The association of fluid volatility with subretinal hyperreflective material and ellipsoid zone integrity in neovascular AMD. Invest Ophthalmol Vis Sci. 2022;63:17.
- Ehlers JP, Zahid R, Kaiser PK, et al. Longitudinal assessment of ellipsoid zone integrity, subretinal hyperreflective material, and subretinal pigment epithelium disease in neovascular age-related macular degeneration. Ophthalmol Retina. 2021;5:1204-1213.
- Ehlers JP, Clark J, Uchida A, et al. Longitudinal higher-order OCT assessment of quantitative fluid dynamics and the total retinal fluid index in neovascular AMD. Transl Vis Sci Technol. 2021;10:29.
- Shaw JE, Sicree RA, Zimmet PZ. Global estimates of the prevalence of diabetes for 2010 and 2030. Diabetes Res Clin Pract. 2010;87:4-14.
- Yau JW, Rogers SL, Kawasaki R, et al. Global prevalence and major risk factors of diabetic retinopathy. Diabetes Care. 2012;35:556-564.
- Williams R, Karuranga S, Malanda B, et al. Global and regional estimates and projections of diabetes-related health expenditure: Results from the International Diabetes Federation Diabetes Atlas, 9th edition. Diabetes Res Clin Pract. 2020;162:108072.
- Abràmoff MD, Lavin PT, Birch M, Shah N, Folk JC. Pivotal trial of an autonomous AI-based diagnostic system for detection of diabetic retinopathy in primary care offices. NPJ Digit Med. 2018;1:39.
- Jiang AC, Srivastava SK, Hu M, et al. Quantitative ultra-widefield angiographic features and associations with diabetic macular edema. Ophthalmol Retina. 2020;4:49-56.
- Ehlers JP, Jiang AC, Boss JD, et al. Quantitative ultra-widefield angiography and diabetic retinopathy severity: An assessment of panretinal leakage index, ischemic index and microaneurysm count. Ophthalmology. 2019;126:1527-1532.
- Ehlers JP, Uchida A, Hu M, et al. Higher-order assessment of OCT in diabetic macular edema from the VISTA Study: Ellipsoid zone dynamics and the Retinal Fluid Index. Ophthalmol Retina. 2019;3:1056-1066.
- Ehlers JP, Uchida A, Sevgi DD, et al. Retinal fluid volatility associated with interval tolerance and visual outcomes in diabetic macular edema in the VISTA Phase III trial. Am J Ophthalmol. 2021;224:217-227.
- Vujosevic S, Midena E. Retinal layers changes in human preclinical and early clinical diabetic retinopathy support early retinal neuronal and Müller cells alterations. J Diabetes Res. 2013;2013:905058.
- Shi R, Guo Z, Wang F, Li R, Zhao L, Lin R. Alterations in retinal nerve fiber layer thickness in early stages of diabetic retinopathy and potential risk factors. Curr Eye Res. 2018;43:244-253.
- Deák GG, Schmidt-Erfurth UM, Jampol LM. Correlation of central retinal thickness and visual acuity in diabetic macular edema. JAMA Ophthalmol. 2018;136:1215-1216.
- Joltikov KA, Sesi CA, de Castro VM, et al. Disorganization of retinal inner layers (DRIL) and neuroretinal dysfunction in early diabetic retinopathy. Invest Ophthalmol Vis Sci. 2018;59:5481-5486.